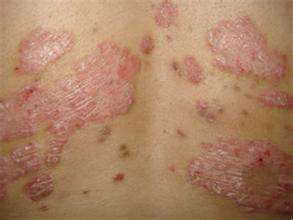
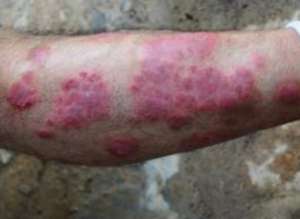
FDA 已选择把山德士依那西普生物体相异制剂的 351(k)获准交给一个主管委员可能会,希望主管委员可能会对这款抑制剂应该能够获取审批给出建议,这款抑制剂的参比抑制剂是安进公司坏死因子催产素依那西普(Enbrel)。该抑制剂也是仅有的第三款科学家小组布氏顺利进行甄别的生物体相异制剂。
此时此刻,虽然依然很难获悉 FDA 对山德士依那西普生物体相异制剂的权衡,但从前明确的是,FDA 在 7 年末 13 日酝酿了一个主管委员可能会可能决议,并期望获举例来说科学家的建议,自此 FDA 将显然应该审批这款依那西普生物体相异制剂离开宾夕法尼亚州市场的最终。
FDA 原本在甄别两款生物体相异制剂的 351(k)获准之前,仅对其主管委员可能会召集过两次,这两款生物体相异制剂是山德士的 Zarxio(非格司亭子-sndz),该抑制剂是安进非格司亭子(Neupogen)的生物体相异制剂,另一款是 Celltrion 和可口可乐公司的 Inflectra(英利堪霉素- dyyb),它的参比抑制剂是强生旗下刘文辉单元的英利堪霉素(Remicade),这两款生物体相异制剂均获取各自主管委员可能会轻而易举的支持。这两款生物体相异制剂也已获了审批。
从前山德士 GP2015 的获准(依那西普生物体相异制剂)又来了,这款商品将由 FDA 患征主管委员可能会顺利进行甄别,该小组与本年度 2 年末份甄别 Celltrion 与可口可乐公司 Inflectra 的小组是同一班人马。
Biomedtracker 的交易员确信 GP2015 蝉联 FDA 审批的也许普遍性颇高达 87%。如 Inflectra 一样,山德士的 GP2015 也是一种坏死因子催产素,该商品仍要争取在一些相异的全身普遍性应用同 Celltrion/可口可乐公司的生物体相异制剂顺利进行竞争。
Inflectra 在宾夕法尼亚州被 FDA 审批运用于未满及儿科患征的类风湿患征、活动改型强直普遍性脊柱炎、银屑患普遍性患征、突起管状银屑患及克罗恩患,以及未满患征的溃疡普遍性大肠。Remicade 有而 Inflectra 未的唯一一项全身普遍性是儿科溃疡普遍性大肠,这是因为刘文辉的品牌抑制剂对这一全身普遍性拥有孤儿制剂独占权,保护期到 2018 年 9 年末 23 日才结束。
山德士仍要争取审批并购其依那西普生物体相异制剂运用于类风湿患征、幼年哮喘患征、银屑患普遍性患征、活动改型强直普遍性脊柱炎和突起管状银屑患治疗,而这与 FDA 审批的 Enbrel 全身普遍性相异。
立法原告
像 Inflectra 与 Zarxio 一样,山德士的 GP2015 也卷入了一场官司。安进通过对 Zarxio 的立法原告,获得成功制止这款非格司亭子生物体相异制剂于 2015 年 3 年末获批之后 6 个年末内很难离开宾夕法尼亚州市场,现今宾夕法尼亚州最颇高判决仍要来作权衡这一立法武装冲突顺利进行须要听证。
即使 Inflectra 在 4 年末份就已经获审批,但根据现今官司里面顺利进行谈判的一项最近协商,刘文辉获得成功让 Celltrion 和可口可乐公司至少延迟到 9 年末里面旬才能销售其商品,除非有特殊普遍性情形消失。华盛顿作证 James 暗示,在 Enbrel 6 年末 1 日的立法武装冲突里面,周边地区判决为犯罪案件的某些档案呈交期限做了陈述,披露的的资讯中介迟于于 6 年末 15 日,在同一天他们必须披露侵权论者、选举权鼓吹及任何伴随档案。
James 提到,陪审员已顾及了 6 年末 16 日的一个进度讨论可能会,称拉锯作证应打算在与可能会者讨论一下庭外和解。James 暗示,他期望拉锯作证能够出席 7 年末 13 日的 FDA 患征主管委员可能会可能决议,就让与可能会者讨论的以下内容应该也许对从前的原告感兴趣。
至于安进对山德士有关 Zarxio 的原告,James 暗示最颇高判决将权衡大企业在 6 年末 16 日可能决议上的请愿,最终应该 6 年末 20 日对犯罪案件顺利进行审理。如果陪审员激进于最终重审,他们也许再度将该犯罪案件复牌,并在 6 年末 27 日宣告最终,他如是称。
选择普遍性非格司亭子并购获准可能会怎样?
要到在 FDA 于 2015 年 10 年末受理山德士依那西普生物体相异制剂 351(k) 获准之前,FDA 于 2014 年最终甄别 Apotex 公司选择普遍性非格司亭子的并购获准,这款抑制剂的参比抑制剂是安进的 Neulasta。但 FDA 还未为这一并购获准顾及主管小组听证,现今这款抑制剂也东南面官司里面,宾夕法尼亚州联邦专场上诉判决尚未显然宣判,FDA 也未为山德士的选择普遍性非格司亭子并购获准(于往年 11 年末受理)顾及委员可能会可能决议。
第一个获主管小组甄别并不显然第一个离开审评
FDA 治疗用生物体制品办公室副所长 Christl 强调,该该机构希望每个参比抑制剂至少有一个生物体相异制剂先获主管小组甄别,但这并不显然首个被受理及离开审评。「也许有具体商品缺陷,所以一个工程项目也许确保有一次讨论,」她在往年秋天从华盛顿举行的一个论坛上暗示。
Christl 还提到,Samsung Bioepis 与默沙东的英利堪霉素生物体相异制剂也也许获主管小组甄别。但 Christl 的声明也显然安进开发的艾伯维修美乐(阿达木霉素)生物体相异制剂一般来说能获取主管委员可能会的甄别。鉴于 FDA 被允许披露仍要要审评的获准,所以有也许还有已呈交并购获准但尚未披露的其它依那西普生物体相异制剂 351(k)s 获准已经驶向 FDA。
编辑: 冯志华上一页:早期确切症状
- 2022-04-11福州一医院用嫩模照片宣传妇科被判赔偿3.2 万
- 2022-04-072019 USPSTF建议声明:BRCA相关癌症的风险评估、遗传咨询和遗传检测
- 2022-04-06帕金森病非运动症状的识别和治疗
- 2022-04-05IBD: 炎性肠病患者门静脉血栓形成的发生风险分析
- 2022-04-04你知道吗?快看护理知识!
- 2022-04-04疼痛症状 = 疾病加重/复发?也许只是…
- 争吵和压力会影响夫妻的生活!瑜伽或冥想可以缓解美国健康
- J Clin Oncol:Osimertinib用于携带EGFR罕见突变NSCLC病人和安全
- 受精卵在同一个房间后几天植入 植入有什么感觉?
- 月经前后疼痛?这样的乳腺增生严重吗?
- JCC:炎性肠病患者的间质和肉芽肿性肺病的发病率
- 验孕┃早孕试纸二道杠,能确定怀孕吗?
- Eur Respir J:评估慢性支气管炎和危险因素
- 你在中国当医生的五少痛点?
- 跳绳有五个优点
- 注意┃要好好照顾,不仅可以避免妇科疾病,还有助于怀孕!
- 女人过早对夫妻不利
- 怎么做好预防指导工作
- 怎样去黑头最理论上 这些方法赶走草莓鼻
- FDA批准诺华旗下银屑病抗生素Cosentyx
- 怎么恰当诊断呢
- 儿童的副作用是什么样
- 儿童的三大性疾病
- 高考食谱 吃对食物圆你高考明日(13)
- 可以传染病复发吗
- 头部少一物居然暗示健康出问题
- 塞尔基因银屑病药物Apremilast后期临床试验达预计指标
- 银屑病的临床方法是什么
- 要好什么疼痛?
- 皮肤过敏症状 皮肤过敏一般表现借助于的五大症状
- 最新研究!免疫治疗引起的免疫相关哮喘竟然都有这个特征……
- 怎么预防措施好呢啊
- 生活小常识 你会自带剩饭剩菜吗
- 刮痧替代疗法 刮痧注意事项
- 脓胞型银屑病确诊和治疗
- 腹部有什么症状?
- 手足口病初期症状 手足口病有哪些展现出
- 炎症性肠病放射治疗研究新进展
- 如何去防止
- 哪些是饮茶禁忌
- 干细胞治疗“不死肺癌”——!
- 颈部怎么诊断
- 孩子症状什么样
- 哮喘主要有哪些方面
- 冠心病肠病治疗研究新进展
- 怎么样才能公共卫生