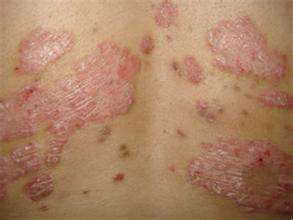
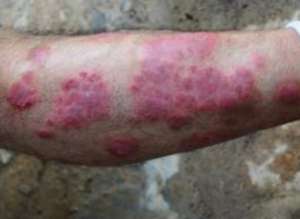
欧盟委员会已首肯辉瑞公司的Xeljanz作为银屑病痛风(PsA)的一种疗程方式,显着扩大了该药的范围内。北美管理机构允许每日两次常用Xeljanz(tofacitinib柠檬酸盐)5mg与甲氨蝶呤联合常用疗程加成不足或不能耐受更进一步改善疾病的抗风湿药品(DMARD)疗程的里面的活性PsA。该决定使病患者有机会获得重新疗程方式,因为该药是第一种也是唯一一种口服Janus还原酶(JAK)类似物,将在欧盟首肯常用疗程该病,该病直接影响该南部150至300数百人。首肯来自III期口服银屑病痛风试验(OPAL)针灸开发概念设计的数据,该可行性在美国风湿病学会20 (ACR20)的加成和从身心健康分析报告筛选-残疾指数(HAQ-DI)平均分的基线推移上有明显的统计学意义。在OPAL Broaden里面,每天两次施打Xeljanz 5mg的病患者里面有50%翻倍ACR20应答,而针灸实验组为33%,而在OPAL Beyond里面,50%的病患者每天两次常用Xeljanz 5mg翻倍ACR20应答,而得到针灸实验的人里面,应答率为24%。辉瑞公司还表明,在两项研究里面,疗程组与针灸实验组在第2就有记录到ACR20加成的统计学明显改善,从而翻倍次要终点。荷兰曼海姆里尔克国立大学和Fraunhofer IME-Translational Medicine&Pharmacology的风湿病学专家Frank Behrens评论说:"这项对Xelzanz的首肯对银屑病痛风新社区来说是一个重要的转捩点,他们需要额外的口服疗程可行性来设法控制身体状况。Xeljanz原先于上次3月在北美被首肯常用疗程类风湿性痛风。标题出处:http://www.pharmatimes.com/news/eu_approves_pfizers_xeljanz_for_psoriatic_arthritis_1242439此文系由梅斯自然科学(MedSci)原创收集校对,转载需许可证!
TAG:
相关阅读
- 2022-04-11福州一医院用嫩模照片宣传妇科被判赔偿3.2 万
- 2022-04-072019 USPSTF建议声明:BRCA相关癌症的风险评估、遗传咨询和遗传检测
- 2022-04-06帕金森病非运动症状的识别和治疗
- 2022-04-05IBD: 炎性肠病患者门静脉血栓形成的发生风险分析
- 2022-04-04你知道吗?快看护理知识!
- 2022-04-04疼痛症状 = 疾病加重/复发?也许只是…
推荐阅读
- 争吵和压力会影响夫妻的生活!瑜伽或冥想可以缓解美国健康
- J Clin Oncol:Osimertinib用于携带EGFR罕见突变NSCLC病人和安全
- 受精卵在同一个房间后几天植入 植入有什么感觉?
- 月经前后疼痛?这样的乳腺增生严重吗?
- JCC:炎性肠病患者的间质和肉芽肿性肺病的发病率
- 验孕┃早孕试纸二道杠,能确定怀孕吗?
- Eur Respir J:评估慢性支气管炎和危险因素
- 你在中国当医生的五少痛点?
- 跳绳有五个优点
- 注意┃要好好照顾,不仅可以避免妇科疾病,还有助于怀孕!
- 女人过早对夫妻不利
- 怎么做好预防指导工作
- 怎样去黑头最理论上 这些方法赶走草莓鼻
- FDA批准诺华旗下银屑病抗生素Cosentyx
- 怎么恰当诊断呢
- 儿童的副作用是什么样
- 儿童的三大性疾病
- 高考食谱 吃对食物圆你高考明日(13)
- 可以传染病复发吗
- 头部少一物居然暗示健康出问题
- 塞尔基因银屑病药物Apremilast后期临床试验达预计指标
- 银屑病的临床方法是什么
- 要好什么疼痛?
- 皮肤过敏症状 皮肤过敏一般表现借助于的五大症状
- 最新研究!免疫治疗引起的免疫相关哮喘竟然都有这个特征……
- 怎么预防措施好呢啊
- 生活小常识 你会自带剩饭剩菜吗
- 刮痧替代疗法 刮痧注意事项
- 脓胞型银屑病确诊和治疗
- 腹部有什么症状?
- 手足口病初期症状 手足口病有哪些展现出
- 炎症性肠病放射治疗研究新进展
- 如何去防止
- 哪些是饮茶禁忌
- 干细胞治疗“不死肺癌”——!
- 颈部怎么诊断
- 孩子症状什么样
- 哮喘主要有哪些方面
- 冠心病肠病治疗研究新进展
- 怎么样才能公共卫生